目次 [非表示]
カルシウムが原因
モルモットではカルシウムによる尿結石ができやすいことが有名ですが、他にもカルシウムが内臓や関節に沈着したり(異所性石灰化)、骨成分が目に発生したり、または骨のカルシウム含有が低下して骨折する(線維性骨異栄養症)などの病態も知られていますが、残念ながらモルモットではカルシウムを初めとするミネラルの代謝について詳細は不明です。カルシウムは有害なものではなく、骨や歯の主要な構成成分になる他、細胞の分裂や分化、筋肉収縮、神経興奮の抑制、血液凝固作用の促進などに関与している必要なミネラルです。
病態
尿結石
異所性石灰化
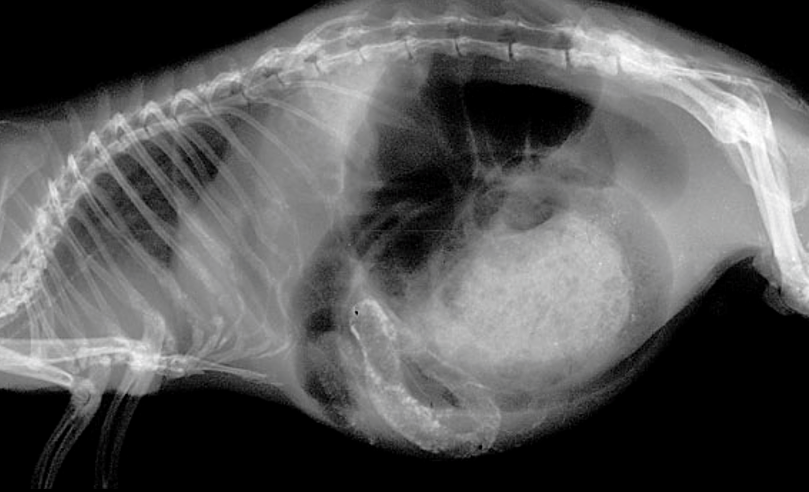
異所性石灰化とは正常骨以外の軟部組織へのカルシウムの非生理的な沈着で、モルモットでは頻繁にみられます〔Percy et al.2016〕。異所性石灰化は沈着部位により様々な障害をもたらしますが、モルモットでは、目、胃腸、肺、関節周囲などに起こりやすいです。石灰化はカルシウムとリンが高い状態が続くと発生し、餌の栄養の不均衡ならびに慢性腎不全〔Percy et al.2016〕が発生要因として考えられていますが、発生や病態に関してはよく分かってはいません。微細な異所性石灰化では無症状で、石灰化の大きさや広がりは様々で、多くは進行が遅いのが特徴です。X線検査で偶発的に発見できるものが多いです。餌の栄養の不均衡は栄養性二次性副甲状腺機能亢進症が発生要因として唱えられていますが、線維性骨異栄養症を起こしていない個体が多いため、実際の関与は不明です。
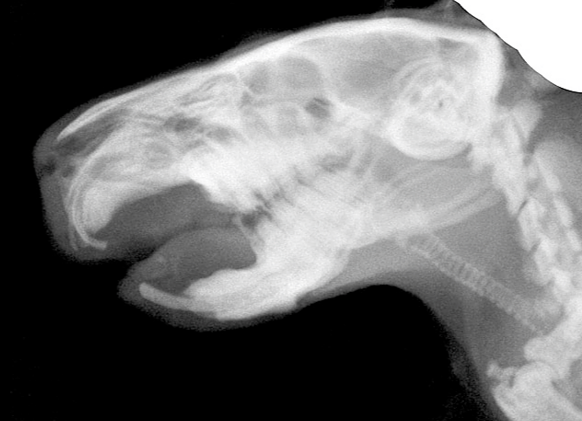
角膜のカルシウム沈着
モルモットでは角膜にカルシウムが沈着することがあります。慢性角膜炎に移行すると血管新生と同時に脂質やコレステロール、カルシウムの異常な蓄積によって、角膜が結晶状沈着物で覆われてきます。

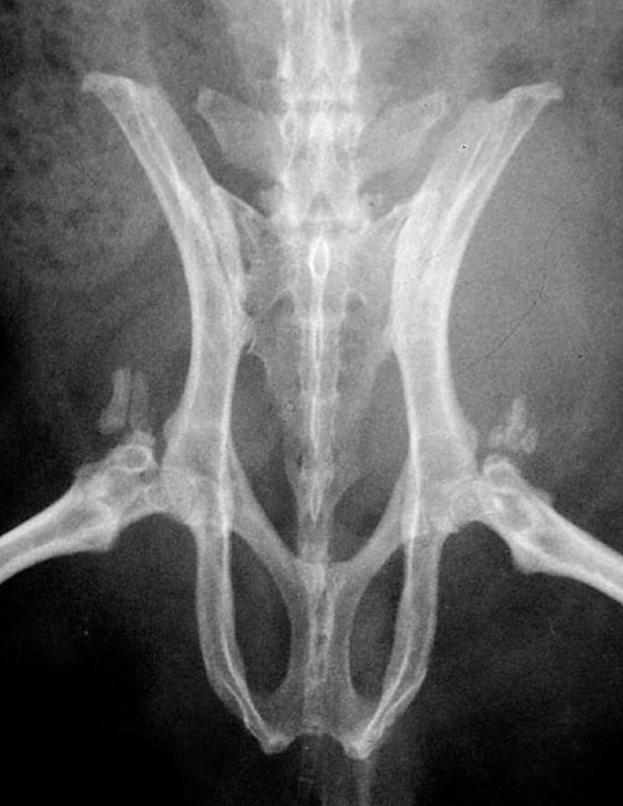
隅角のカルシウム沈着
隅角虹彩角領域(隅角付近)の石灰化は骨性分離腫と呼ばれ、分離腫の骨化には骨細胞が存在しますので、単純な組織の石灰化は無細胞です。したがって、この病態は骨性分離腫と呼ばれて、石灰化の一種ではありません。

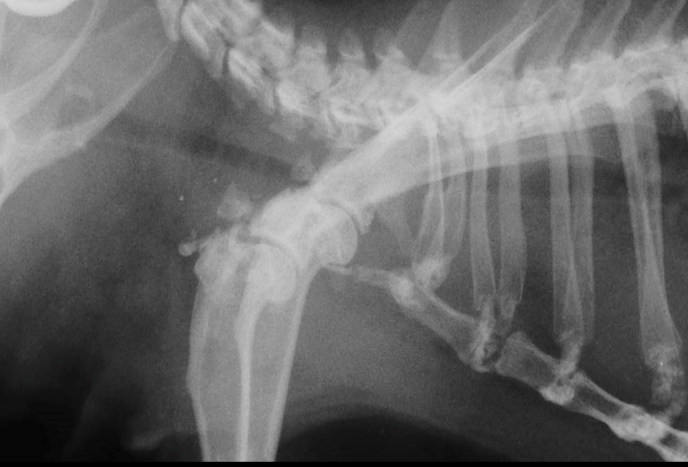
線維性骨異栄養症
骨が線維化を起こして脆くなる病態で、骨折を起こしやすくなります。通常の外傷による骨折とは発生の意味合いが異なります。線維性骨異栄養症を引き起こす原因として、副甲状腺機能亢進症(上皮小体機能亢進症)があげられ、過剰に副甲状腺ホルモン(PTH:parathormone:パラソルモン)が分泌された結果、骨に影響を与えます。モルモットの副甲状腺の裏側で甲状腺葉に囲まれて位置しています〔Zabel et al.1986〕。副甲状腺機能亢進症には副甲状腺自身の異常を原因とする原発性副甲状腺機能亢進症とカルシウム代謝の破綻を原因とする二次性副甲状腺機能亢進症とに区別され、モルモットでは後者の二次性副甲状腺機能亢進症が主です。副甲状腺ホルモンの過剰な分泌は、血中のカルシウム濃度が低下すると分泌が高まり、骨に含まれているカルシウムを血中に溶出させ、腎臓に作用してリンの再吸収を抑制し、カルシウムの再吸収を促して尿中への排泄を減らします。 また、腎臓におけるビタミンDの活性化を促進して、活性型ビタミンDの作用によって腸管からのカルシウムの吸収を増加させます。骨のカルシウムを血液中に溶出させることから、骨が線維化を起こして、骨痛や骨変形・病的骨折などの原因となります〔Hawkins et al.2012〕。また、過剰な副甲状腺ホルモンは、身体の様々な場所へのカルシウムを沈着(異所性石灰化)させたり、心臓血管系、胃腸腸管、胆嚢、気管、子宮および精管の平滑筋の弛緩も引き起こすと言われています〔Motomura et al.1998,Kline et al.2000〕。二次性副甲状腺機能亢進症は幼体に好発する栄養性副甲状腺機能亢進症と中高齢に好発する腎性副甲状腺機能亢進症があげられます。栄養性副甲状腺機能亢進症はカルシウムとリンの摂取量が不均衡、ビタミンDの不足が原因です。しかし、モルモットにおける明確な文献などの報告は少なく、これまでの報告では10ヵ月齢のメス、2歳のオス、1歳のオスのモルモットで発生した例があるに過ぎません〔Rapsch et al. 2009,Schwarz et al.2001〕。腎性副甲状腺機能亢進症は慢性腎不全になりやすい中高齢にみられ、腎臓でのリンの排泄およびビタミンD3の活性化ができなくなります。また活性化ビタミンD3が低下すると、腸管からのカルシウムの吸収が低下します。
カルシウム要求量
治療は食餌療法が必須で、適切なCa:P(1.5:1)のエサに修正し、ビタミンDの補充も行うことが基本ですが〔Hawkins et al.2012〕、それぞれの栄養素の具体的な推奨値が示すことができないことが現状です。カルシウム(Ca)、リン(P)、カリウム(K)、マグネシウム(Mg)などのバランスが崩れることによって軟部組織の石灰化が起こりやすくなります。過去の発表されている栄養推奨値は、0.9~1.1%のCa、0.6~0.7%のP、0.3~0.4%のMg、0.4~1.4%のK〔Hollamby 2009〕。0.8%のCa、0.4%のP、0.1%のMg、0.5%のK〔Nutrient Requirements of the Guinea Pig 1995〕などになりますが、信頼性などは不明です。
| ミネラル | 文献〔Hollamby 2009〕 | 文献〔Nutrient Requirements of the Guinea Pig 1995〕 |
| カルシウム(Ca) | 0.9~1.1% | 0.8% |
| リン(リン) | 0.6~0.7% | 0.4% |
| マグネシウム(Mg) | 0.3~0.4% | 0.1% |
| カリウム(K) | 0.4~1.4% | 0.5% |
Hogan と Regan (1946)らは、モルモットの軟部組織の石灰化の原因として過剰なリンを指摘し〔Hogan et al.1946〕、Caが0.8%/kgとPが0.9%のエサを与えられたモルモットの 90%に発生したが、Pが0.5%に低下すると発生が10%未満に低下した報告がされています〔Hogan et al.1950〕。その後の実験では、MgとKの補給により、モルモットの軟部組織の石灰化を起こす過剰なPの影響が予防されました〔House et al.1955〕。モルモットのMgの必要量は、エサのCa、P、Kの濃度に深く関与し、Mgが欠乏することでも軟部組織の石灰化が起こり得ます〔Morris et al.1961〕。一方でカルシウム沈着に深く関与するビタミンDに関しても詳細なことは分かっていません。モルモットを暗い部屋で飼育したり、低CaやビタミンDのエサを与えると、成長不良やくる病、切歯のエナメル質形成不全(不正咬合)〔Howe et al.1940〕、 血中のCaおよびPが低下し、骨のカルシウム含有量は約4/ 5と低下します〔Sergeev et al.1990〕。しかし、ビタミンDが過剰になると、高カルシウム血症、腎臓、大動脈、筋肉、脾臓、心臓、肝臓などの石灰化を引き起こしますので〔Camberos et al.1970〕、最大用量として1600IU/kg餌を越さないように注意して下さい〔Hawkins et al.2012〕。
参考文献
- Hawkins MG,Bishop CR.Disease problems of guinea pigs.In Ferrets,rabbits,and rodents: clinical medicine and surgery.3rd ed.Quesenberry KE,Carpenter JW eds.Elsevier/Saunders.St Louis.MO:p295-310.2012
- Hollamby S.Rodents:neurological and musculoskeletal disorders.InKeeble E,Meredith A eds.BSAVA Manual of Rodents and Ferrets, BSAVA.Gloucester:161-168.2009
- Hogan AG,Regan WO.Diet and calcium phosphate deposits in guinea pigs.Fed Proc5(1 Pt 2):138.1946
- Hogan AG,Regan WO.House WB.Calcium phosphate deposits in guinea pigs and the phosphorus content of the diet.J Nutr1041(2):203-213.1950
- House WB,Hogan AG,Injury to guinea pigs that follows a high intake of phosphates; the modifying effect of magnesium and potassium.J Nutr55(3):507-517.1955
- Howe PR,Wesson LG,Boyle PE,WolbachSB.Low calcium rickets in the guinea pig.Proc.Soc.Exp.Biol.Med45.298‐301.1940
- Kline LW,Benishin CG,Pang PK.Parathyroid hormone (PTH) and parathyroid hormone-related protein (PTHrP) relax cholecystokinin-induced tension in guinea pig gallbladder strips. Regul Pept91:83‐88.2009
- Motomura Y,Chijiiwa Y,Iwakiri Y et al.Interactive mechanisms among pituitary adenylate cyclase-activating peptide, vasoactive intestinal peptide, and parathyroid hormone receptors in guinea pig cecal circular smooth muscle cells. Endocrinology139:2869-78.1998
- Nutrient Requirements of the Guinea Pig.Nutrient Requirements of Laboratory Animals.Fourth Revised Edition.The National Academies Press.Washington DC.1995
- Percy DH,Barthold SW.Pathology of Laboratory Rodents and Rabbits.4rd.Blackwell Publishing.Ames IA.2016
- Rapsch Dahinden C,Klawitter A,Sagawe J et al.Course of Osteodystrophia fibrosa generalisata in a satin guinea pig.Schweiz Arch Tierheilkd151:233‐237.2009
- Schwarz T,Stork CK,Megahy IW et al.Osteodystrophia fibrosa in two guinea pigs.J Am Vet Med Assoc 219:63‐66, 49.2001
- Sergeev IN,Arkhapchev YP,Spirichev VB.Ascorbic acid effects of vitamin D hormone metabolism and binding in guinea pigs.J.Nutr120.1185–‐190.1990
- Zabel M,Surdyk J,Biela-Jacek I.Immunocytochemical study of the distribution of S-100 protein in the parathyroid gland of rats and guinea pigs. Histochemistry86:97‐99.1986
